Тема «Железо и его соединения» в школьных программах по химии
В программе школьного курса химии на изучении темы «Железо и его соединения» отводится 5 часов; эта тема разбита на следующие подразделы: Общие понятия о положении железа в периодической системе химических элементов и строение атома. Основные методы получения железа-восстановление из оксидов железа и электролиз водных растворов солей железа. Физические, химические свойства и применение. Основные соединения железа и их получение. Экологические аспекты данной темы в школьной литературе изложены очень поверхностно или не изложены вовсе.
В школьных учебниках «Химия.9 класс»/Г. Е. Рудзитис, Ф. Г. Фельдман, «Химия. 9класс»/Н. С. Ахметов, и Пособие по химии для поступающих в вузы/ Г. П. Хомченко, на эту тему выделено три основных параграфа: § 1.Положение железа в периодической системе химических элементов и строение атома § 2.Нахождение железа в природе,его получение, свойства и применение § 3.Соединения железа, и мы будем рассматривать каждый параграф более подробно.
§ 1. Положение железа в периодической системе химических элементов и строение атома
Fe
d- элемент VIII группы; порядковый номер – 26; атомная масса – 56; (26p11; 30 n01), 26ē[1]
|
|
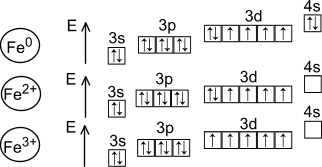
1s22s22p63s23p63d64s2 |
Металл средней активности, восстановитель.
Основные степени окисления - +2, +3
§ 2. Нахождение железа в природе,его получение и свойства
Нахождение в природе.
Железо является вторым по распространенности металлом в природе (после алюминия). В свободном состоянии железо встречается только в метеоритах, падающих на землю [2]. Наиболее важные природные соединения:
Fe2O3 • 3H2O - бурый железняк;
Fe2O3 - красный железняк;
Fe3O4(FeO • Fe2O3) - магнитный железняк;
FeS2 - железный колчедан (пирит).
Соединения железа входят в состав живых организмов.
Получение железа.
В промышленности железо получают восстановлением его из железных руд углеродом (коксом) и оксидом углерода (II) в доменных печах [1, 3]. Химизм доменного процесса следующий:
C + O2 = CO2,
CO2 + C = 2CO.
3Fe2O3 + CO = 2Fe3O4 + CO2,
Fe3O4 + CO = 3FeO + CO2,
FeO + CO = Fe + CO2.
Его также можно получить:
1)восстановлением железа из его оксида, например, ![]() водородом при нагревании;
водородом при нагревании;
2)восстановлением железа из его оксидов ![]() и
и ![]() алюминотермическим методом;
алюминотермическим методом;
3)электролизом водных растворов солей железа (II) [1].
Физические свойства.
Железо – серебристо серый металл, обладает большой ковкостью, пластичностью и сильными магнитными свойствами. Плотность железа – 7,87 г/см3, температура плавления 1539°С [1].
У Хомченко [3] также написано, что железо легко намагничивается и размагничивается, а потому применяется в качестве сердечников динамомашин и электромоторов. Кроме того, железо состоит из четырех стабильных изотопов с массовыми числами 54, 56(основной), 57 и 58. Применяются радиоактивные изотопы ![]() и
и ![]() .
.
Химические свойства
В реакциях железо является восстановителем. Однако при обычной температуре оно не взаимодействует даже с самыми активными окислителями (галогенами, кислородом, серой), но при нагревании становится активным и реагирует с ними:
2Fe + 3Cl2 = 2FeCl3 Хлорид железа (III)
3Fe + 2O2 = Fe3O4(FeO · Fe2O3) Оксид железа (II,III)
Fe + S = FeS Сульфид железа (II)
При очень высокой температуре железо реагирует с углеродом, кремнием и фосфором:
3Fe + C = Fe3C Карбид железа (цементит)
3Fe + Si = Fe3Si Силицид железа
3Fe + 2P = Fe3P2 Фосфид железа (II)
Железо реагирует со сложными веществами.
Во влажном воздухе железо быстро окисляется (корродирует):
4Fe + 3O2 + 6H2O = 4Fe(OH)3,
O
Fe(OH)3 = Fe
O – H + H2O
Ржавчина
Железо находится в середине электрохимического ряда напряжений металлов, поэтому является металлом средней активности. Восстановительная способность у железа меньше, чем у щелочных, щелочноземельных металлов и у алюминия. Только при высокой температуре раскаленное железо реагирует с водой(700-900):
Подробно о педагогике:
Подготовка и проведение педагогического эксперимента по модели
стимулирования эвристической деятельности младшего школьника на уроках
природоведения
«Образование без воспитания нравственности - это взращивание угрозы обществ» (Теодор Рузвельт). Приобщение ребенка с ранних лет к природе, возвращение его к естественной среде обитания имеет очень большое значение не только для формирования его нравственности, но в еще большей степени отвечает совр ...
Педагогическая наука в XIX веке
С XVIII века начинается профессиональная подготовка учителей. В 1732 году, в частности, открывается первая учительская семинария в Германии (г. Штеттин). В 1779 году учреждается педагогическая (учительская) семинария при Московском университете, а с 1804 года последовало открытие в России педагогич ...
Современные инновации в сфере общего образования
Начиная с 1992 года, в России реформируется система общего образования. На сегодняшний день в данной сфере разворачивается несколько проектов изменений, наиболее широко распространенные из них: развивающее обучение, единый государственный экзамен (ЕГЭ), профильное обучение. Основателем того, что по ...
Разделы
- Главная
- Язык и речь
- Мотивация учения у младших школьников
- Изучение и воспитание одаренных детей
- Обучение письму на начальном этапе
- Правовое просвещение
- Коррекционная педагогика
- Актуально о образовании