Изучение темы «Железо и его соединения» на уроке по химии в средней школе
? Исходя из строения атома железа, определить его валентные электроны.
Учитель. Железо имеет 8 валентных электронов (два из них на 4s- и шесть на 3d-АО). Однако валентность 8 для железа не характерна; неустойчивы и соединения с шестивалентным железом, например производные железной кислоты H2FeO4, являющиеся сильнейшими окислителями. Обычно железо проявляет валентности равные двум и трем и соответствующие степени окисления.
? Какими свойствами обладает железо как простое вещество?
(Учитель предлагает совершить следующую остановку).
IV. Третья остановка “Физические свойства”( работа в парах). Учащиеся работают с учебником, справочной литературой и записывают в тетрадь характерные физические свойства:
Цвет:
Металлический блеск:
Твердость:
Пластичность:
Теплопроводность:
Электропроводность:
Плотность:
Температура плавления:
Железо - серебристо-белый или серый металл, твердый, с высокой пластичностью, теплопроводностью и электропроводностью, плотность его равна 7,87 г/см3, тугоплавкий-1540?С. Это самый распространенный химических элементов в природе. В земной коре его массовая доля составляет 5,1%.
Учитель проверяет выполненную работу в виде беседы с классом.
? Какими ещё свойствами обладает железо?
Учитель. Да, в отличие от других металлов, железо способно намагничиваться, оно обладает ферромагнетизмом.
Демонстрация опыта: намагничивание железных опилок.
? Какова активность железа?
Учитель обращает внимание учащихся на электрохимический ряд напряжения металлов. Для того, чтобы узнать активность железа по отношению к другим веществам, мы совершаем с вами очередную остановку.
V. Четвёртая остановка. Экспериментальная. “Химические свойства железа”.
Учитель. Железо взаимодействует как с простыми, так и сложными веществами. Предлагаю вам провести эксперименты с серой, соляной кислотой, сульфатом меди, объяснить свои наблюдения и составить уравнения химических реакций.
? Чем является железо в данных уравнениях реакций? (На экране появляется второй слайд).
Fe + S = FeS
Fe + 2HCI = FeCI2 + H2
Fe + CuSO4 = FeSO4 + Cu
Fe0 - 2e = Fe+2 (восстановитель)
? Что вы наблюдали при проведении третьей реакции? (Железо вытеснило медь из раствора сульфата меди).
? Действует ли вода и кислород на железо?
Учитель. При обычных условиях вода не действует на железо, однако, в присутствии кислорода протекает следующая реакция: (на экране появляется слайд №3)

Fe(OH)3 - гидроксид железа (III) - основная часть ржавчины. Для протекания данной реакции необходимо одновременно присутствие воды и кислорода, в противном случае коррозия так и не наступит. Известно, что в течение многих столетий стоит знаменитая железная колонна в столице Индии Дели. Почему? (Там сухой воздух).
Учитель. Предлагаю учащимся провести опыт: реакцию обмена между сульфатом железа (II) и гидроксидом меди, записать уравнение химической реакции в молекулярном и ионном виде (на экране появляется слайд № 4).
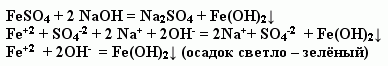
Учитель предлагает учащимся вновь вернуться к полученному осадку и посмотреть на изменение цвета.
? Как изменился цвет осадка? Что произошло?
Учитель. Соединение железа двухвалентного неустойчиво и окисляется, превращаясь в соединение железа трехвалентного бурого цвета (слайд № 5).
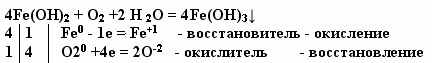
? Может вытеснять железо водород из воды?
Да, может, но только при сильном нагревании (запись на доске).
Fe + H2O = FeO +H2
Fe0 - 2e = Fe+2 - восстановитель - окисление
2H+ + 2е = Н2 - окислитель - восстановление
? Какие два оксида образует химический элемент железо? (FeO и Fe2O3)
? Какими свойствами они обладают? (Основными).
При окислении железа в высокотемпературном режиме образуется железная окалина:
3 Fe +2O2 = Fе 3O 4
Учитель. Что вы узнали во время данной остановки? Какими свойствами обладает железо как простое вещество? Сделайте вывод.
VI. Остановка № 5. “ Подумай!” (слайд № 6).
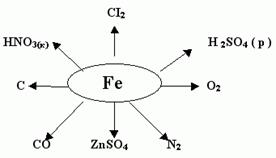
(Письменная работа, в результате которой учащиеся должны написать возможно протекающие реакции).
VII. Остановка № 6. “Значение железа” (сообщение ученика)
Биохимики раскрывают огромную роль железа в жизни растений, животных и человека. Входя в состав гемоглобина, железо обуславливает красный цвет этого вещества, от которого, в свою очередь, зависит цвет крови. В организме взрослого человека содержится 3 г железа, из них 75% входят в состав гемоглобина, благодаря которому осуществляется важнейший биологический процесс - дыхание. Железо необходимо и для растений. Оно участвует в окислительных процессах протоплазмы, при дыхании растений и в построении хлорофилла, хотя само и не входит в его состав.
Подробно о педагогике:
Методика работы по формированию у детей временных представлений на занятиях
по математическому развитию
Ориентировка во времени детей младшей группы. В младшей группе уточняют представление детей о таких промежутках времени, как утро, день, вечер и ночь. Части суток малыши различают по изменению содержания их деятельности, а также деятельности окружающих их взрослых в эти отрезки времени. Точный расп ...
Изучение темы «Железо и его соединения» на уроке по
химии в средней школе
Железо: его строение и свойства “Век девятнадцатый, железный, Воистину жестокий век! Тобою в мрак ночной, беззвездный Беспечный брошен человек!” Цели урока: сформировать представление о физических и химических свойствах железа в зависимости от проявляемой им степени окисления и природы окислителя; ...
Самоанализ урока музыки
Тема урока: "Что за прелесть эти сказки!" Урок дан по программе "Музыка" Е.Д.Критской, Г.П.Сергеевой, Т.С. Шмагиной в 4 классе. В разделе "День, полный событий" это 2 урок, на котором идет углубление темы, где учащиеся знакомятся с творчеством А.С.Пушкина во взаимосвяз ...
Разделы
- Главная
- Язык и речь
- Мотивация учения у младших школьников
- Изучение и воспитание одаренных детей
- Обучение письму на начальном этапе
- Правовое просвещение
- Коррекционная педагогика
- Актуально о образовании

